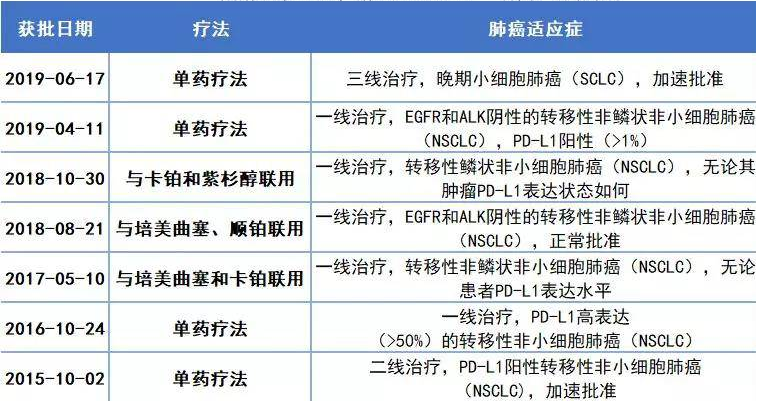
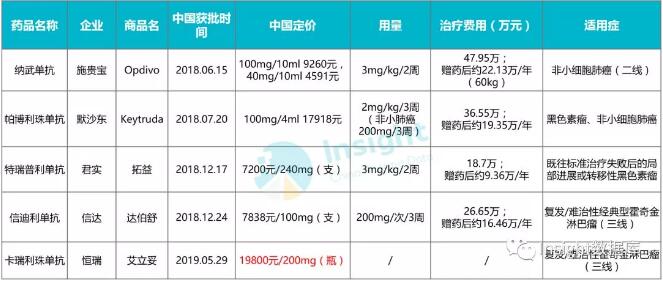
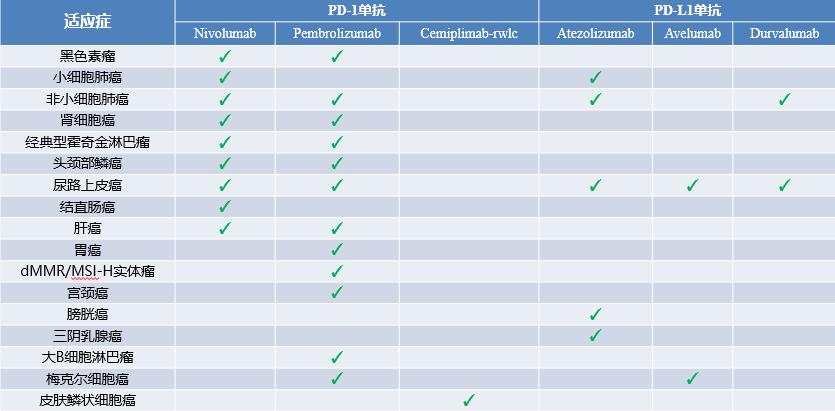
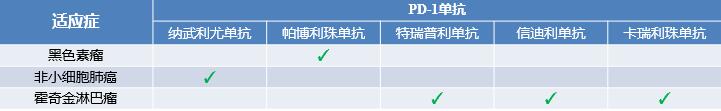
Opdivo (Nivolumab) 在华获批第2项适应症:头颈部鳞状细胞癌
9月30日,Opdivo新适应症申请(JXSS1900001、JXSS1900002)获得NMPA批准
用于治疗接受含铂类方案治疗期间或之后出现疾病进展且肿瘤PD-L1表达阳性(定义为表达PD-L1的肿瘤细胞≥1%)的复发性或转移性头颈部鳞状细胞癌(SCCHN)患者
这是Opdivo在中国获批的第2项适应症
头颈部肿瘤占全身恶性肿瘤的5%,是世界范围内第6大常见的恶性肿瘤。2002年全球新发病例超过50万例,相关死亡高达30万例。头颈部肿瘤发病部位通常包括:唇、口腔、口咽、喉、下咽,唾液腺,鼻咽、鼻、鼻窦、中耳等。亚洲,特别是广东、香港、东南亚地区是口腔癌以及鼻咽癌的全球最高发地区
2016年11月,FDA基于关键性III期临床研究(CheckMate-141)的结果批准Opdivo用于治疗铂难治复发性或转移性头颈部鳞状细胞癌(SCCHN)患者。这项代号为CheckMate -141的开放标签、随机、III期研究在接受过铂类药物的复发或转移性SCCHN患者中比较了Opdivo与甲氨蝶呤+多西他赛+西妥昔单抗的治疗差异。
结果表明,接受Opdivo治疗的患者较对照组在总生存期(OS)方面表现出了显著优越性(中位OS:7.5 vs 5.1个月),并且死亡风险显著了降低30%。另外,Opdivo治疗组的1年生存率为36%,对照组为16.6%。Opdivo在中国最早于2018/6/15获得NMPA批准,用于治疗表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性、既往接受过含铂方案化疗后疾病进展或不可耐受的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者