2023年中国NMPA批准的新药大盘点
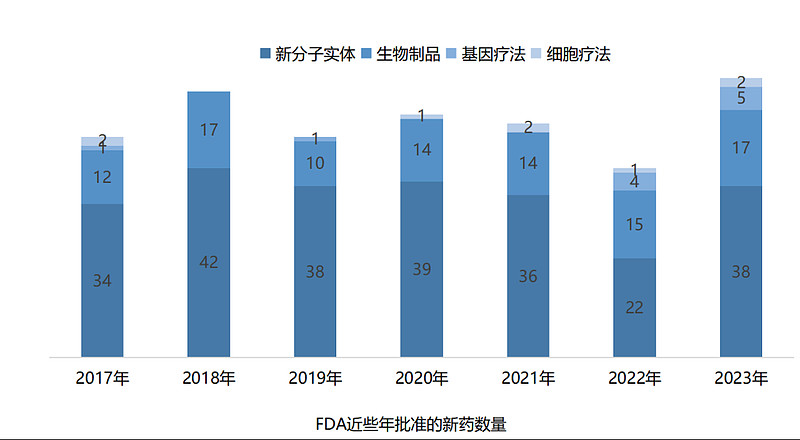
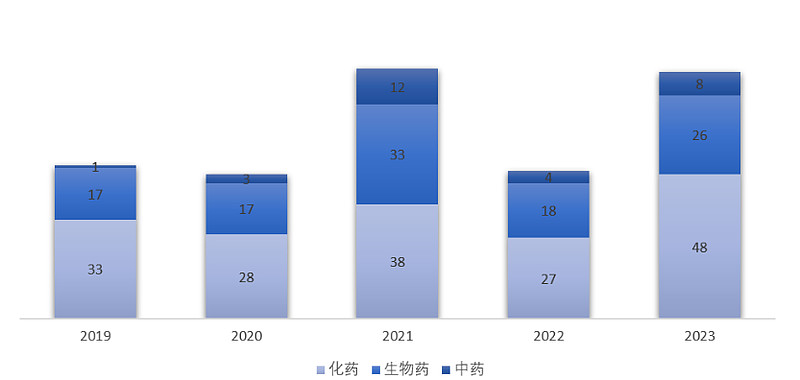
2023年,国家药品监督管理局(NMPA)累计批准了82款新药,包括48款化药(小分子、小核酸)、22款生物药(单抗、双抗、ADC、细胞疗法、酶替代疗法、融合蛋白、血液制品)、4款疫苗以及8款中药。与往年相比,2023年NMPA批准新药数量显著上涨,几乎与近五年的历史峰值持平
(新药定义为:NMPA首次批准的活性成分、中药、疫苗、细胞疗法,不包括新适应症、新剂型、生物类似药;若复方中包含的活性成分非首次批准,不纳入统计)
从疾病领域来看,肿瘤领域仍是创新药物聚集地,2023年新药占比达到33%(24款),无论是肺癌、乳腺癌等较为常见的实体瘤,还是血液肿瘤、肾癌、骨肿瘤、神经纤维瘤、宫颈癌等患者群体相对较少但恶性程度不低的瘤种,都有创新产品获准上市
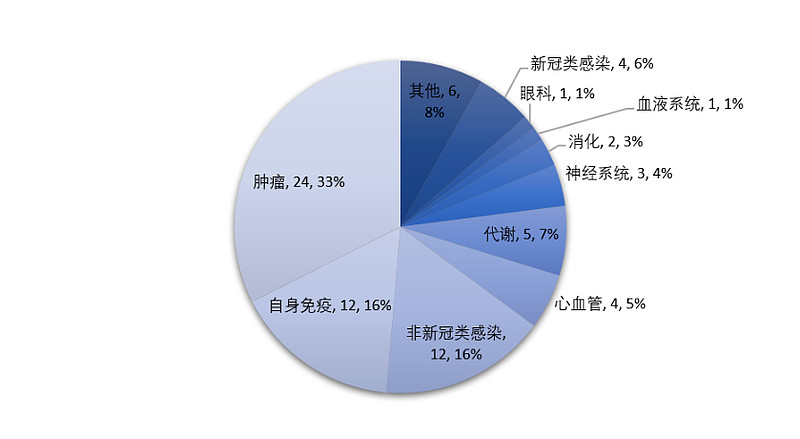
同时,银屑病、斑秃等在内的多种自身免疫疾病也迎来了TYK2抑制剂氘可来昔替尼、IL-23p19单克隆抗体药物替瑞奇珠单抗、JAK3/TEC激酶家族双通道抑制剂利特昔替尼等创新靶点分子。心血管领域,尤其是降血脂领域,涌现出多种多样的药物类型,例如小干扰RNA英克司兰、PCSK9单克隆抗体托莱西单抗......
本土创新力持续迸发
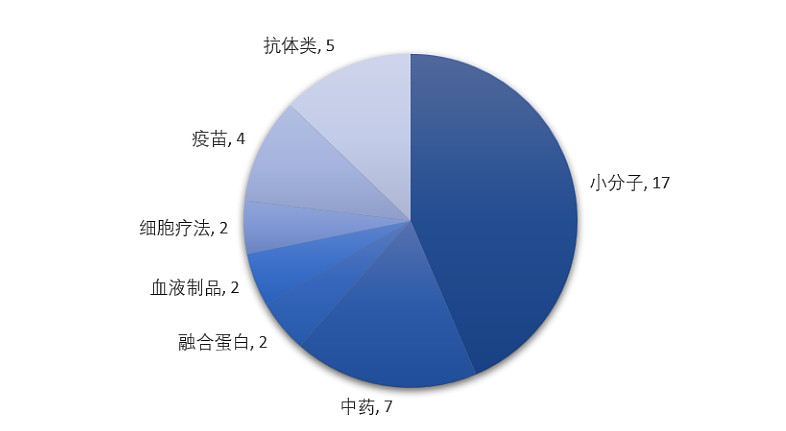
本年度,NMPA批准的82款新药中有近48%出自国产(39款),涵盖小分子、抗体类、细胞疗法、融合蛋白、血液制品以及疫苗、中药等多种药物类型,遍布肿瘤、自身免疫、消化、心血管、感染等疾病领域
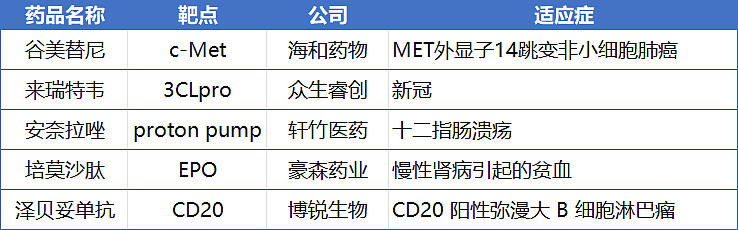
近年来,国内生物医药产业持续发展,本土创新力量不断迸发。2023年共有5款first-in-class药物得到监管机构认可,分别是来自海和药物的c-Met抑制剂谷美替尼、众生睿创的3CL蛋白酶抑制剂来瑞特韦、轩竹医药的质子泵抑制剂安奈拉唑、豪森药业的EPO药物培莫沙肽以及博锐生物的泽贝妥单抗
除了源头创新的突破,国内企业也在成熟靶点或者作用机制上持续深耕。在过去一年中,有6款分别针对肺癌不同亚型突变的新药,包括治疗MET外显子14跳变NSCLC的谷美替尼、治疗EGFR T790M突变阳性NSCLC的贝福替尼、治疗ALK阳性NSCLC的伊鲁阿克、治疗EGFR 20号外显子插入突变NSCLC的舒沃替尼、治疗MET外显子14跳变NSCLC的伯瑞替尼以及治疗广泛期小细胞肺癌的阿得贝利单抗接连走向临床,为肺癌精准治疗增添了多种选择。
同时,在小分子以及抗体之外,国内新型疗法的创新成果也十分显著。两款国产细胞疗法,信达生物/驯鹿生物联合开发的BCMA CAR-T疗法伊基奥仑赛以及合源生物研发的CD19 CAR-T疗法纳基奥仑赛纷纷获NMPA优先审评进入市场,适应症分别为成人复发或难治性多发性骨髓瘤、B细胞急性淋巴细胞白血病
进口药“零时差”惠及中国患者
据统计,2023年NMPA共批准了43款进口药物,包括化药(30款小分子、1款小核酸)、生物药(8款抗体、2款ADC、1款酶替代疗法)以及中药(1款),涉及的治疗领域广泛且创新药物类型丰富
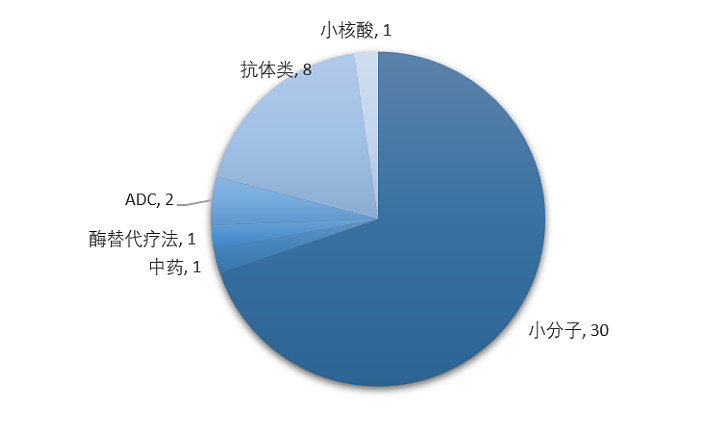
同时,有9款临床急需用药,包括阿斯利康的神经纤维瘤药物司美替尼、罗氏的弥漫性大B细胞淋巴瘤ADC药物维泊妥珠单抗、阿斯利康/第一三共的乳腺癌ADC药物德曲妥珠单抗、罗氏的眼科药物法瑞西单抗、赛诺菲的庞贝病酶替代疗法等产品都顺利获批上市。
鉴于中国庞大的人口基数和患者群体,跨国药企们都积极推动创新药在中国尽早落地,在华开设中国研发中心,力争与全球同步研发、同步注册、同步获批。勃林格殷格翰的first-in-class药物佩索利单抗就是首个实现中国与全球同步研发、注册以及获批的创新药,仅晚于FDA批准3个月。该产品于2022年12月正式在国内获批上市,用于治疗成人泛发性脓疱型银屑病。
2023年以来,这类与全球研发无限接轨的创新药案例也越来越多。比如,辉瑞研发的JAK3抑制剂利特昔替尼胶囊就实现了全球同步研发和同步注册,6月获FDA批准上市后不到4个月再次获得NMPA优先审评上市,用于12岁及以上青少年和成人重度斑秃。
罗氏的格菲妥单抗在中国的上市速度也几乎与全球同频,6月中旬在美上市后,紧接着在11月也登陆中国市场,用于治疗既往接受过至少两线系统性治疗的复发或难治性弥漫大B细胞淋巴瘤成人患者。此外,罗氏也率先在中国递交了新一代C5补体抑制剂可伐利单抗治疗阵发性睡眠性血红蛋白尿症的上市申请,有望成为罗氏首个以中国作为全球首发地的创新药物。
未来,随着多方的重视和努力下,进口创新疗法的中国速度或将越来越快,能够实现更早更快地惠及中国患者。
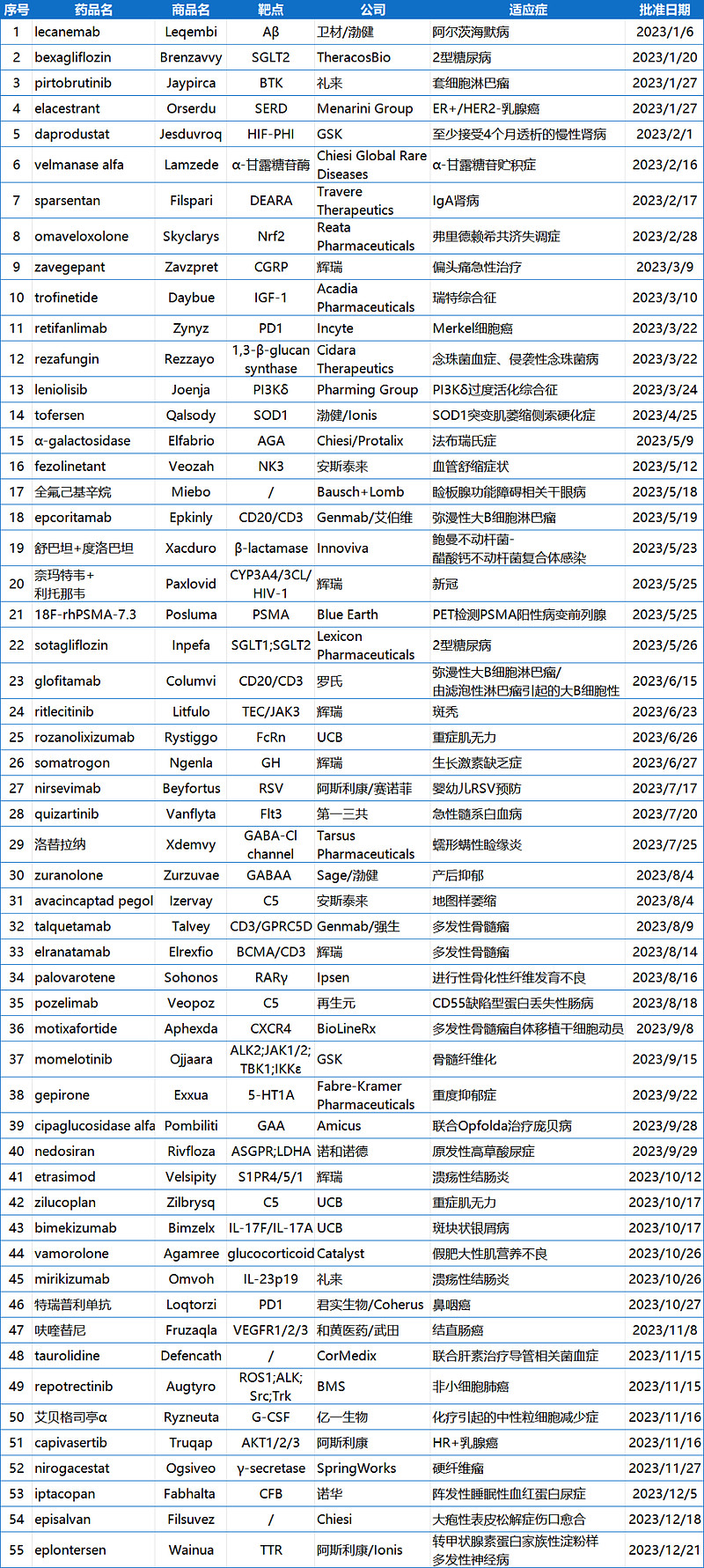
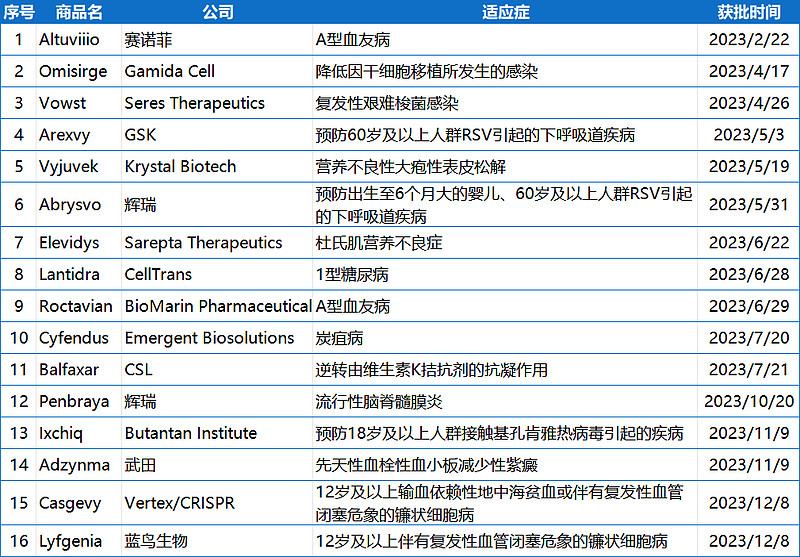
附表:2023年NMPA批准的新药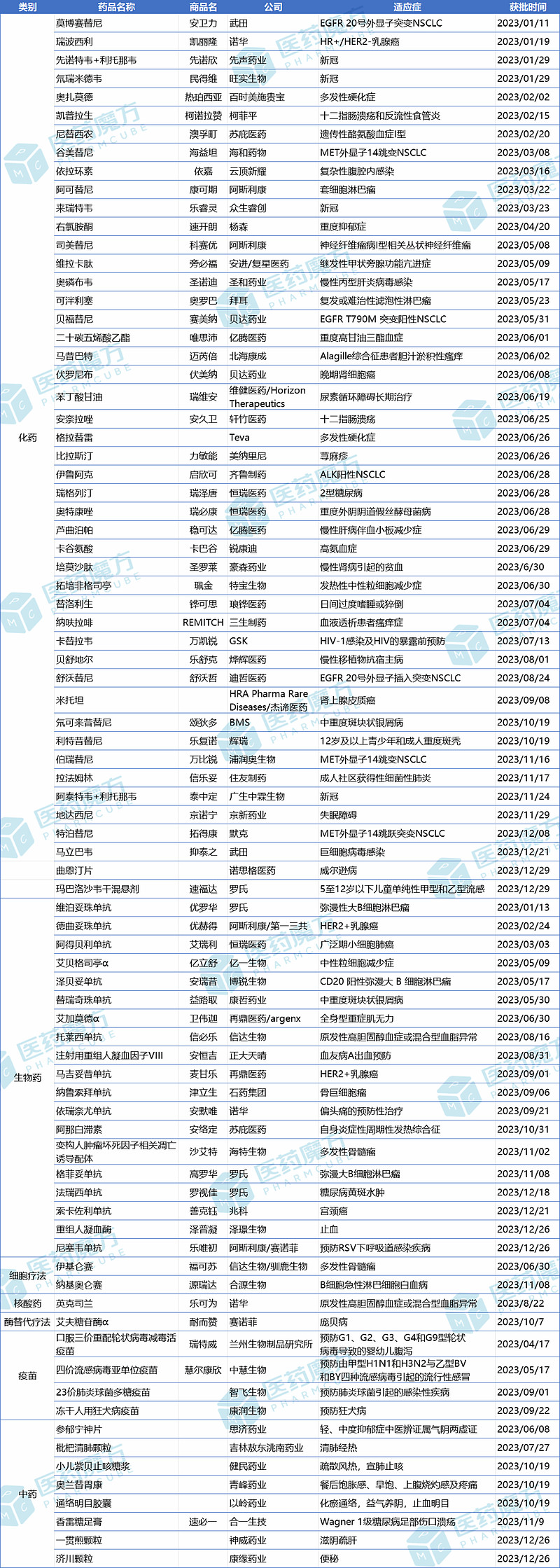
参考来源:医药魔方