截至目前(2019年12月)中国已上市PD-1/PD-L1单抗一览
自去年6月首款PD1单抗在国内上市后,在短短1年半的时间内共有6种不同的PD1/PDL1单抗在中国上市
六种免疫治疗药物研究及适应症
1.欧狄沃 Opdivo(纳武利尤单抗) 用法:3mg/kg,2周一次。
适应症及循证证据:
① 作为中国最早上市的PD1单抗,O药在国内获批的首个适应症为二线治疗晚期NSCLC。该获批也是基于世界首个以中国人群为主的III期研究CheckMate078。与多西他赛相比,O药二线治疗显著延长了患者的总生存期(OS),为12 vs 9.6个月,降低了32%的死亡风险,并且提高了ORR(客观缓解率),为17% vs 4%。最新的两年随访结果,O药组2年生存率为28%,多西他赛组只有18%。
② O药第二项国内适应症为治疗接受铂类化疗进展后且PDL1表达阳性的晚期头颈鳞癌患者。在III期研究CheckMate141研究中,与标准治疗相比(多西他赛、甲氨蝶呤或西妥昔单抗),O药组的2年生存率提高了近3倍达到16.9%(标准治疗组为6.0%),O药组的中位OS延长至7.7个月(另一组为5.1个月),死亡风险降低32%。在PDL1阳性的亚组中,与标准治疗相比,接受O药治疗患者的两年生存率提高超5倍达到18.5%(标准治疗组3.4%),中位生存期达到8.2个月(标准治疗组4.7个月),死亡风险降低45%。
2.可瑞达Keytruda(帕博利珠单抗) 用法:2mg/kg,3周一次。
适应症及循证证据:
① K药最早在国内获批的是二线治疗晚期黑色素瘤。与化疗相比,K药治疗表现出持续的OS收益:12个月总体生存率,K药治疗组为70.3%,化疗组为54.8%;18个月总体生存率,K药治疗组为61.2%,化疗组为43.0%。
② K药单药在中国一线治疗EGFR/ALK阴性晚期NSCLC的适用人群先后从PDL1≥50%扩展到PDL1≥1%。这主要是基于Keynote042研究结果。与化疗相比,K药治疗PDL1阳性患者可延长OS,中位OS为16.7 vs 12.1个月,在中国人群中的OS对比为20 vs 13.7个月。
③ K药联合化疗一线治疗EGFR/ALK阴性晚期非鳞状NSCLC的适应症获批是基于Keynote189研究。相比化疗,K+化疗患者中位PFS分别为8.8 vs 4.9个月;ORR分别为47.6%和18.9%。K+化疗降低了51%死亡风险。
④ K+化疗一线治疗EGFR/ALK阴性晚期肺鳞癌是基于Keynote407研究。相比于单纯化疗,K药联合化疗显著改善了OS(mOS:17.1 vs. 11.6个月;HR=0.71)和PFS(mPFS:8.0 vs. 5.1个月;HR=0.57),并显著提升了ORR(62.6% vs 38.4%)。
3.拓益(特瑞普利单抗) 用法:3mg/kg,2周一次。
适应症及循证证据:
特瑞普利单抗获批是基于一项II期研究CT4。在治疗晚期黑色素瘤中,单药的ORR为17.3%,DCR(疾病控制率)为57.5%,中位PFS为3.6个月,中位OS未达到(18个月OS率为52.91%)。其中二线的ORR为22.58%。
4.达伯舒(信迪利单抗) 用法:200mg,3周一次
适应症及循证证据:
信迪利单抗获批用于后线治疗霍奇金淋巴瘤是基于ORIENT-1这项II期研究。结果显示,ORR为79.2%,95.8%的患者都出现肿瘤缩小,其中34%的患者达到了CR(完全缓解)。
5.艾瑞卡(卡瑞利珠单抗) 用法:200mg,2周一次。
适应症及循证证据:
与信迪利单抗一样的适应症,也是用于后线治疗霍奇金淋巴瘤。ORR为77.3%,DCR为97%,CR率为31.8%,6个月PFS率为84.6%。
6.英飞凡IMFINZI(度伐利尤单抗) 用法:10mg/kg,2周一次。
适应症及循证证据:
I药是国内获批的PDL1单抗,适应症为用于不可手术切除的III期NSCLC在同步放化疗后疾病未进展时的巩固治疗。该获批也是基于III期研究PACIFIC的结果。研究结果显示,相比于安慰剂,接受I药的患者中位PFS延长了接近一年(17.2 vs 5.6个月)。 在生存时间方面,I药组患者的3年OS率达到57%,而安慰剂只有43.5%,这意味着超过半数的局晚期患者用I药成功活过了3年。此外,I药也提高了ORR(28.4% vs 16%)及延长了发生死亡或远处转移的时间(28.3 vs 16.2个月)。
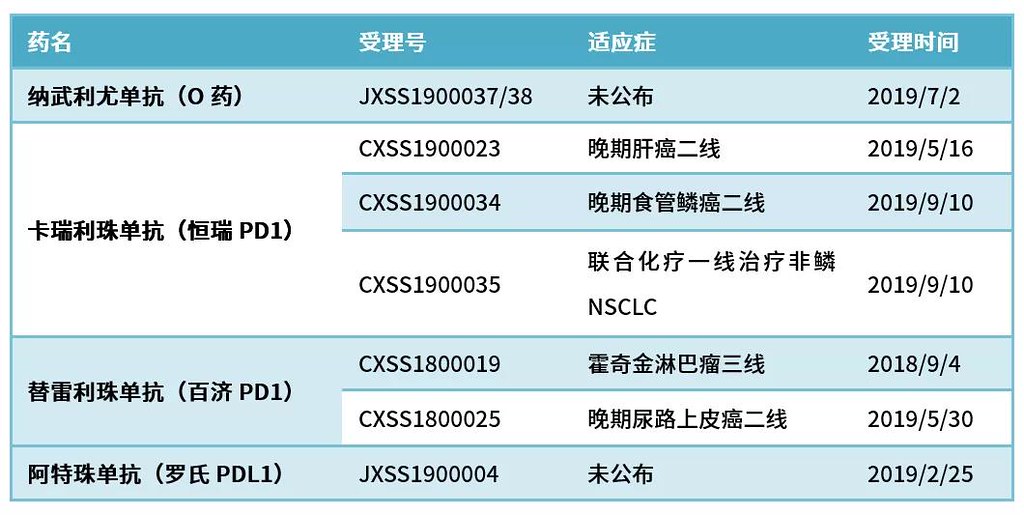
近期中国有望获批的PD1/PDL1药物或适应症