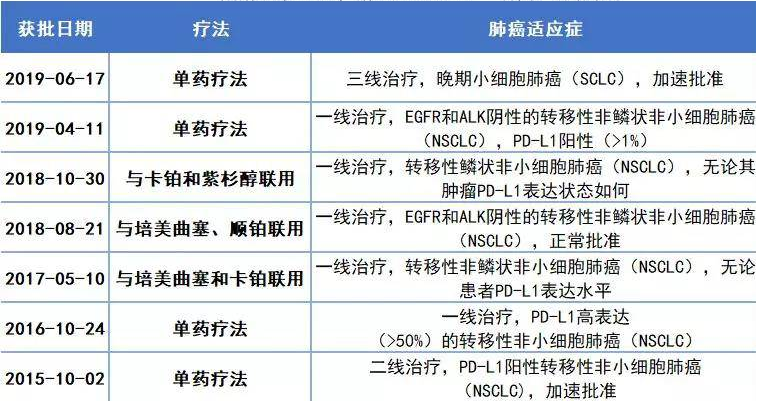
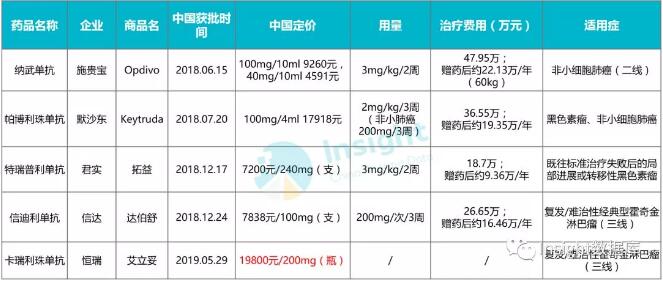
2019年6月2日,在美国芝加哥召开的ASCO大会上,PD-1单抗药KEYTRUDA(俗称K药)的五年生存数据正式公布了。
数据到底怎么样?
这个数据,来自临床试验KEYNOTE-001,患者是晚期非小细胞肺癌(NSCLC),使用的是K药单药治疗。这是K药最早开始的临床试验,所以对患者的随访时间最长,得到的这个数据,也是目前史上最长的患者使用K药治疗之后的生存数据。
具体结果是这样的:
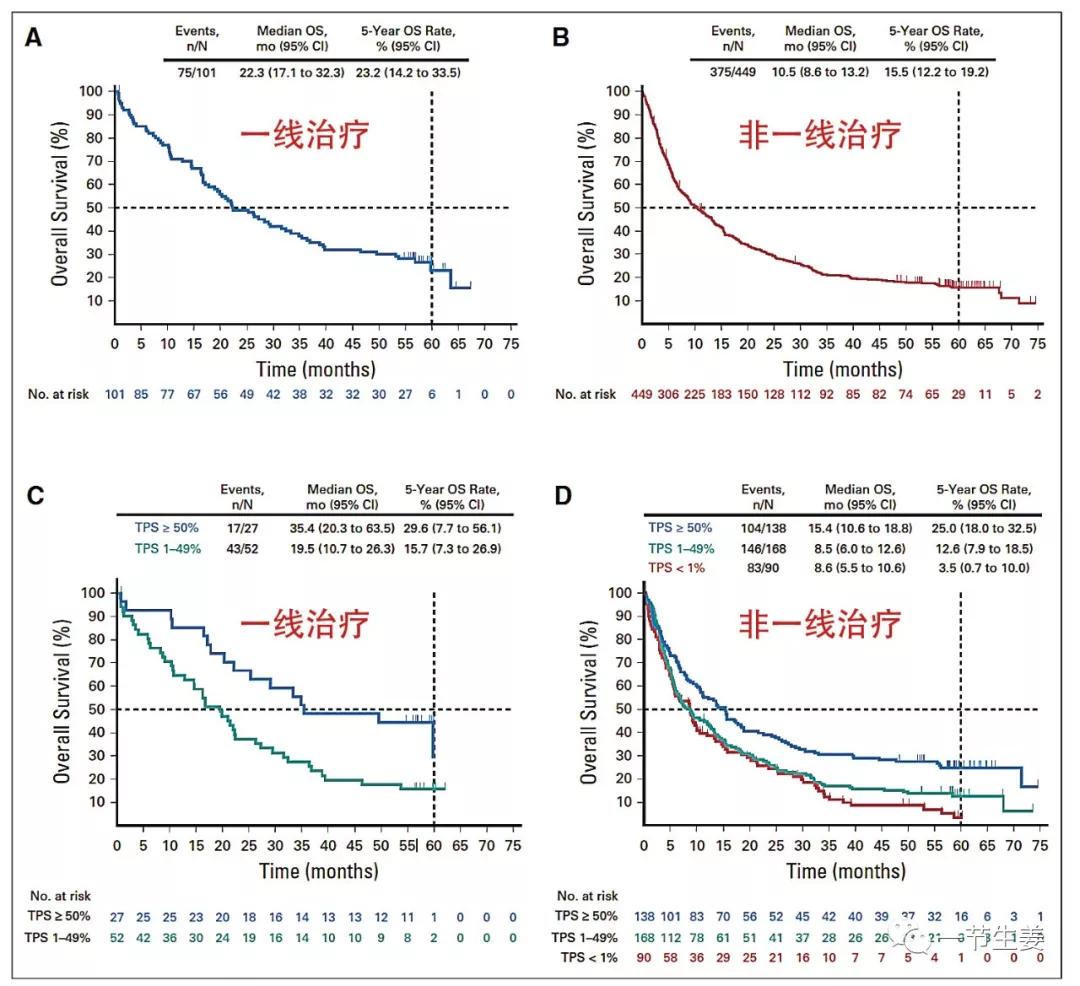
- 一线治疗5年总生存率(OS)为23.2%(患者101例);其中PD-L1高表达的患者(肿瘤表达评分[TPS])≥50%),效果更好,达到29.6%;
非一线治疗,从治疗开始计算,5年OS为15.5%(患者449例);其中PD-L1高表达的患者,5年OS为25.0%。
这些数据如何解读呢?
1.PD-1抗体K药的效果杠杠的
曾经有人质疑免疫癌症免疫治疗的效果,认为这也就是一波商业炒作,除了让患者多花钱进行治疗,也许短期有所获益,但是长期不见得真正有啥用。
目前K药的适应症主要是晚期患者,要想突然有个神药驾着七彩祥云出现,把晚期癌症就都治愈了,那就使劲想吧,因为这也就只能幻想一下。
现实是什么呢?对于晚期患者,延长生命,让患者得到长期生存,把癌症变成一个慢性病,这就是一个很现实的小目标。
5年总生存率就是衡量患者长期生存的一个指标。对于常规化疗来说,NSCLC患者5年生存率只有5.5%。
这个现实比较残酷,但确实是免疫治疗到来之前的现实。如今的长期随访结果显示,使用K药,可以把晚期NSCLC患者的长期生存率整体提高3倍!
生活中有很多喜闻乐见的“神药”,各种“治愈”,各种包治百病。如果习惯了那些虚假宣传,可能不会觉得今天K药的数据不怎么样,直觉上会这样认为:即便23%的人获得长期生存,不是还有80%左右的人都达不到长期生存吗?
大家可以这样考虑一下:中国每年的肺癌新增加病例是73万人[2],其中大约50%是晚期NSCLC[3],以前只有2.9万人在治疗后可以获得5年以上生存;如今有了K药,8.4万人因此就有机会生存超过5年!
你说这效果到底是不是杠杠的呢?
当然,K药确实不是神药,不是任何患者都可以用来作为救命的最后稻草。
2. 哪些人更容易从K药获益?
从发表的结果看,肿瘤PD-L1高表达的患者,从K药的获益会更好,一线治疗后总生存中位数达到35.4个月,5年生存率接近30%,如果是二线以后治疗,5年生存率也可以达到25%。
相比之下,如果肿瘤PD-L1表达不够高(TPS 1%~49%),5年生存率在一线治疗后是15.7%,二线治疗后只有12.6%。如果PD-L1几乎不表达,二线治疗后只有3.5%的人可以生存超过5年。
所以,对于肿瘤PD-L1高表达的患者来说,K药治疗性价比是最高的。从统计数据来看,这部分人的比例大约是三分之一。
需要指出的是,PD-L1的表达只是一种筛选办法,如今发现其他的一些生物标记物,如TMB(肿瘤突变负荷)、MSI-H(微卫星不稳定性高)、DDR(DNA损伤修复)缺陷等,也可以用来甄选对PD-1/PD-L1抗体药敏感的人群。这些指标都是相互独立的,比如PD-L1表达不高的人,如果TMB比较高,也属于对免疫治疗敏感的人群。
此外,如果能坚持使用K药两年以上,获得长久生存的可能性就更高。
在所有参加临床试验的患者中,有11%坚持K药治疗两年以上,这些患者(共计60名)绝大部分(85%)在治疗中都获得了缓解,5年生存率也非常惊艳:75%!所以,只要能扛过两年治疗,那获得长久生存就是一个大概率事件。
在美国,K药不但推到晚期NSCLC患者一线使用,还推进到了对更早期的患者进行治疗。2019年4月,K药获得FDA批准,用于治疗III期不可进行手术的患者。只要PD-L1有表达(TPS≥1%),K药就可以用于一线治疗,疗效优于化疗。
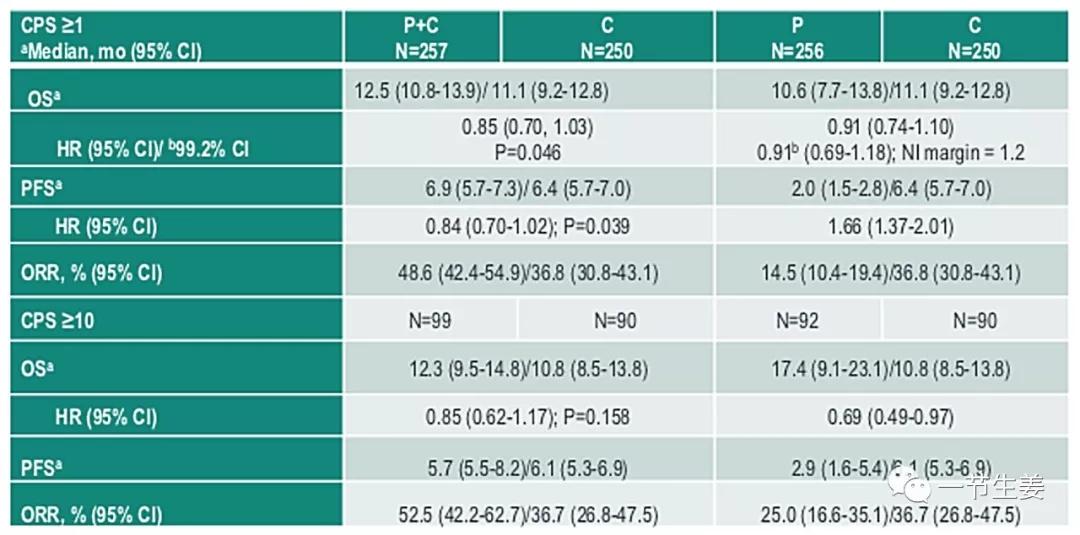
在今年的ASCO大会上,一项K药用于胃癌一线治疗的临床研究结果也引起了重视。在这个KEYNOTE-062临床试验里,患者都是HER2阴性进展期胃癌或者胃/食管交界癌,此类患者目前除了化疗,别无选择。该临床试验比较了使用化疗、K药、K药+化疗进行一线治疗的效果,发现在PD-L1高表达的患者中,K药单独使用比标准化疗有优势,生存期中位数从10.8个月提高到了17.4个月,2年生存率也从22%提高到了39%。
2018年,K药正式登陆中国。今年3月,国家药品监督管理局批准了K药的肺癌一线治疗适应症,联合培美曲塞、顺铂治疗转移性非鳞状NSCLC(EGFR和ALK阴性)。
【参考文献】
- Garon EB, Hellmann MD, Rizvi NA,Carcereny E, Leighl NB, et al. (2019) Five-Year Overall Survival for PatientsWith Advanced Non‒Small-Cell Lung Cancer Treated With Pembrolizumab: ResultsFrom the Phase I KEYNOTE-001 Study. Journal of Clinical Oncology:JCO.19.00934.
- ChenW, Zheng R, Baade PD, Zhang S, Zeng H, et al. (2016) Cancer statistics inChina, 2015. CA Cancer J Clin 66:115-132.
- ChenY, Han S, Zheng M-J, Xue YLiu W-C (2013) Clinical characteristics of 274non-small cell lung cancer patients in China. Oncology Research and Treatment36:248-254.
- Gadgeel SM, et al. KEYNOTE-189: Updated OS andprogression after the next line of therapy (PFS2) with pembrolizumab (pembro)plus chemo with pemetrexed and platinum vs placebo plus chemo for metastaticnonsquamous NSCLC. J Clin Oncol 37, 2019 (suppl; abstr 9013).
- Tabernero J, et al. Pembrolizumab with or withoutchemotherapy versus chemotherapy for advanced gastric or gastroesophagealjunction (G/GEJ) adenocarcinoma: The phase III KEYNOTE-062 study.JClin Oncol 37, 2019 (suppl; abstr LBA4007).
援引自:http://www.sohu.com/a/318414329_100038691