Keytruda首次获批治疗晚期小细胞肺癌(SCLC)
6月18日,默沙东(MSD)公司宣布,美国FDA加速批准该公司的重磅PD-1抑制剂Keytruda治疗晚期小细胞肺癌(SCLC)患者。这些患者已经接受过铂基化疗和至少一种其它前期疗法,然而疾病继续进展。这标志着Keytruda首次获批治疗SCLC,也意味着这款重磅癌症免疫疗法现在可以治疗非小细胞肺癌(NSCLC)和SCLC两种肺癌的最主要类型。
肺癌无论在世界范围内是导致癌症死亡的首要原因,SCLC约占肺癌总数的10-15%。大部分SCLC患者在确诊时,疾病已经处于晚期。与NSCLC相比,SCLC的疾病进展速度更快,美国SCLC患者的5年生存率只有6%。
默沙东公司开发的抗PD-1疗法Keytruda是免疫检查点抑制剂领域的重磅药物。它通过抑制PD-1受体介导的免疫抑制信号,提高人体免疫系统发现和攻击肿瘤细胞的能力。这款重磅疗法自2014年首次获得FDA批准治疗晚期黑色素瘤以来不断扩展其适应症。在肺癌领域更是疗效显著,已经获得多项FDA批准,作为组合疗法或单药疗法,一线治疗NSCLC。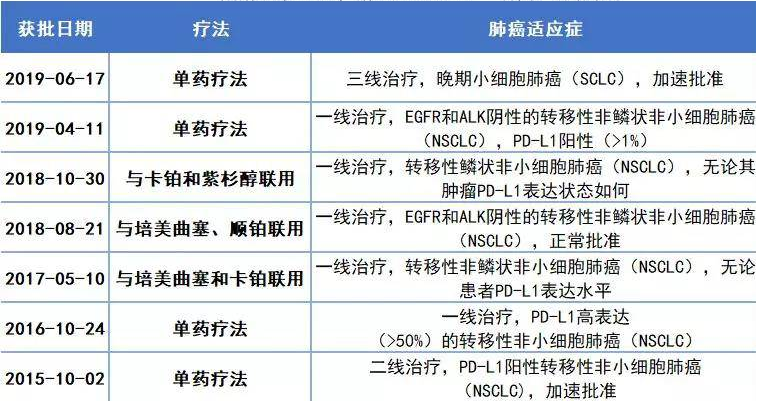
本次批准主要基于Keytruda在名为KEYNOTE-158的2期临床试验(n=64)和KEYNOTE-28的1b期临床试验(n=19)中的表现。在这两项试验中,接受过2次以上前期治疗,但是疾病继续进展的患者接受了Keytruda的治疗。
对这两项试验中患者的汇总分析表明,Keytruda的总缓解率达到19.3%,其中,2名患者达到完全缓解,14名患者达到部分缓解。得到缓解的患者中,半数以上患者的缓解持续时间超过18个月。
我们期待这款重磅癌症免疫疗法能够为更多肺癌患者造福。
援引自:菠菜信息
相关资料:
[1] FDA Grants Priority Review to Merck’s Supplemental Biologics License Application for KEYTRUDA® (pembrolizumab) Monotherapy for Third-Line Treatment of Patients with Advanced Small Cell Lung Cancer (SCLC). Retrieved June 17, 2019, from https://www.businesswire.com/news/home/20190220005296/en/FDA-Grants-Priority-Review-Merck%E2%80%99s-Supplemental-Biologics
[2] Keytruda label. Retrieved June 17, 2019, from https://www.accessdata.fda.gov/drugsatfda_docs/label/2019/125514s053lbl.pdf