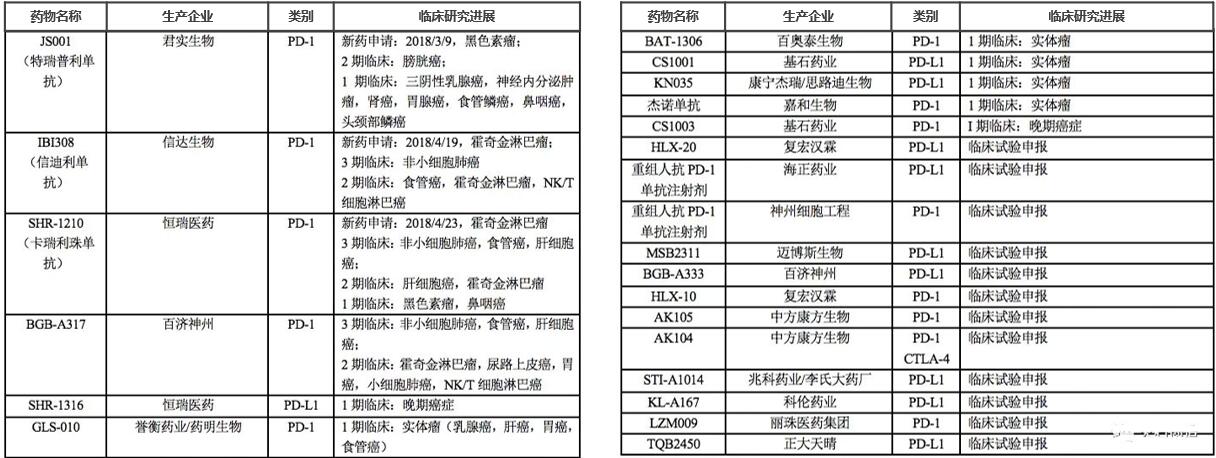
PD-1/PD-L1抗体药物:K药、O药、T药、I药、B药
目前,全球上市的免疫检查点抑制剂PD-1或PD-L1抑制剂共5个,如下:
O药:Opdivo(Nivolumab),
K药:Keytruda(Pembrolizumab),
T药:Tecentriq(Atezolizumab),
I药:Imfinzi(Durvalumab),
B药:Bavencio(Avelumab)。
最近一段时间, Opdivo® 与 Keytruda® 相继在国内获批上市,并且 Opdivo®在国内的价格也已全面公布,中国的患者终于迎来了真正的免疫治疗元年!
关于PD-1患者关心的 6 大问题
一、副作用及其处理方法
肿瘤免疫治疗作为治疗癌症的一把利器,有利也会有弊。它对抗肿瘤的效果我们有目共睹,但也不能忽视其副作用,唯有充分认识,积极治疗,才能取得更好的疗效!
免疫治疗相关常见副作用
内分泌异常:甲状腺炎、甲状腺功能减退、甲状腺功能亢进、下垂体炎、垂体功能减退症、肾上腺功能不全;
肺部:肺炎、呼吸衰竭;
消化道:恶心、呕吐、腹泻、结肠炎、穿孔和胰腺炎;
神经:神经病、脑膜炎、格林-巴利综合征;
皮肤:黏膜炎、皮疹、白癜风;
肝脏:转氨酶升高、肝炎;
视力:虹膜炎、葡萄膜炎、结膜炎;
心脏:心包炎;肾脏:肾炎、肾功能不全;
导致这些毒副作用的原因为:T细胞浸润、细胞因子、自身抗体。
处理方法
(一)乏力、食欲下降、恶心、甲状腺功能减退等,应该如下处理
加强监督
患者首次接受治疗的4-6周期,每一周期治疗后都需要对身体状态进行评估;
患者首次接受治疗的4个周期,每次去医院均需进行甲状腺、肝功能、电解质检测;
患者应加强学习,提高自己的医学知识;
患者应善于向医生咨询;
治疗方法
1级不良事件,对症治疗,继续使用ICI(免疫检查点抑制剂);
2级不良事件,每天0.5-1.0mg强的松,同时使用ICI,一旦重新出现1级,则每天10mg的强的松;
3级不良事件,每天1-2mg强的松、 英利昔单抗,4-6周后,类固醇需逐渐减量,如需要重新使用PD-1/PD-L1,请高度谨慎;
4级不良事件,每天1-2mg强的松、英利昔单抗、其他的免疫抑制剂,停止使用ICI(内分泌病除外)。
注意:使用CTLA4(细胞毒T淋巴细胞相关抗原4)的患者,免疫治疗相关不良事件的发生率更高。
(二)皮疹
皮疹的类型:皮炎、痤疮样皮炎、大疱性皮炎、红疹、瘙痒、红斑疹、周身皮疹、斑丘疹、发痒皮疹等,罕见的有:中毒性表皮坏死松解症和史蒂芬强森症候群。
皮疹的处理:
可能出现瘙痒但无皮疹的症状;
大疱发生变化,需要咨询皮肤科医生;
评估黏膜的损伤程度。
(三)甲状腺功能不全的治疗
定期进行TFT检测,如TSH(促甲状腺激素)>10mlU/L,则开始进行甲状腺素治疗。
(四)肝脏毒副作用的治疗
发生率:5-10%;
无症状肝酶升高时,则开始使用类固醇治疗;
不要使用英利昔单抗;
类固醇耐药者,则使用吗替麦考酚酯和他克莫司。
(五)腹泻处理
定期评估腹泻程度;
如果您开始使用类固醇了,要进行CT扫描或者结肠镜检查;
溃疡预示着出现了类固醇耐药。
(六)肺炎
肺炎的发生率为5%,若使用PD-1/PD-L1联合CTLA4治疗,则发生率为10%;
与之前是否做过胸部RT无显著相关;
发作的中位时间为2.8个月(9天-19.2个月);
88%的肺炎为1或2级。
肺炎的治疗:
1级肺炎:没有明显症状,仅仅是影像学发生了改变;
2级肺炎:服用类固醇48小时后没有改善,应当作3级来处理;
3/4级肺炎:静脉注射类固醇,考虑支气管镜检和抗菌素试验性治疗,考虑英利昔单抗。
(七)肾脏
急性肾损伤
免疫+化疗组发生率为5.2%,化疗组为0.5;
最常见的不良事件发生在急性疾病的位置,也可能是多因素导致的。
肾炎:发生率为1.7%派姆单抗/培美曲塞/卡铂组,0.5安慰剂/培美曲塞/卡铂组。
3-4级免疫治疗相关不良事件发作时间
发作中位时间<6个月;
毒副作用可能更晚些;
免疫联合治疗的发作时间相对更早些。
免疫治疗相关不良事件治疗后,使用PD-1/PD-L1再次发作的情况,凯特琳癌症中心纳入了482例肺癌患者,15%的患者出现免疫治疗相关不良事件,如下:
54%出现了复发;
24%出现了相同的免疫相关不良事件,26%出现了新的免疫相关不良事件;
6例患者获得成功治疗,2例死亡。
对于在出现免疫治疗相关不良事件之前就获得响应的患者,是否再次接受 ICP 治疗,其复发率没有差异。
PD-1/PD-L1和自身免疫性疾病(AID)
23%出现了AID耀斑,通常为1-2级;
38%患者出现了免疫相关不良事件;
其中,6例患者出现了3-4级的免疫相关不良事件,对于出现 AID 的患者,可以考虑采用 ICP 治疗。
毒副作用概述:与纳武单抗单药治疗相比,纳武单抗联合伊匹单抗的皮疹、瘙痒、腹泻、甲状腺功能减退发生率更高;不良事件相关的中止治疗的发生率更高。治疗相关的死亡率为0.5%-1.2%。
小结:
疲乏和恶心是常见的不良事件,并且可能没有免疫基础;
皮疹、甲状腺功能异常是最常见的免疫相关不良事件,肺炎的发病率为2%-5%;
2级及以上的免疫相关不良事件采用类固醇治疗,对于类固醇耐药者,则使用英利昔单抗;
复发和患有自身免疫性疾病的患者可以使用免疫治疗,但是需要谨慎。
二、PD-1抑制剂的疗效如何?
在绝大多数、未经挑选的实体瘤中,单独使用PD-1抑制剂的有效率,其实并不高:10%-30%左右。唯一的例外,是经典型霍奇金淋巴瘤,有效率突破60%以上。
PD-1抑制剂有效率偏低,为何能获得医生、患者及其家属的极度关注呢?主要的原因是:PD-1抑制剂疗效的持久性。由于免疫系统具有记忆功能,因此一旦PD-1抑制剂起效,其中部分病友实现临床治愈。尤其是较早的恶性黑色瘤、肾癌以及非小细胞肺癌中,都已经观察到了类似的现象;PD-1抑制剂的出现,将晚期恶性黑色素瘤和晚期非小细胞肺癌的生存率提高了数倍;晚期恶性黑色素瘤的5年生存率从15%左右,提高到了35%上下;而晚期非小细胞肺癌的5年生存率从5%左右,提高到了15%上下!
此外,通过联合治疗,把原来不适合PD-1抑制剂治疗的病人,转化为可以从中获益的人群也可以提高治疗效果。目前,PD-1抑制剂主流的搭档有如下几个:
联合另一种免疫治疗药物:PD-1抑制剂联合CTLA-4抗体,已经被批准用于恶性黑色素瘤;在肾癌、TMB高的非小细胞肺癌中三期临床试验已经成功。此外,IDO抑制剂、TIM-3抑制剂、LAG-3抗体等新型的免疫治疗新药,正在研发中。
联合化疗:PD-1抑制剂联合化疗,已经被批准用于晚期非鳞非小细胞肺癌一线治疗;类似的方案,用于胃癌、肠癌、三阴性乳腺癌等也有不错的初步数据。
联合放疗:PD-1抑制剂联合放疗,在肺癌、恶性黑色素瘤等肿瘤中,已有不错的数据;
联合靶向药:PD-1抑制剂联合抗血管生成的靶向药(贝伐、阿西替尼、乐伐替尼、卡博替尼等),已有不错的初步数据;但联合EGFR抑制剂(如易瑞沙、特罗凯、凯美钠、阿法替尼、泰瑞沙等),需要当心,可能发生严重的副作用。
联合溶瘤病毒:PD-1抑制剂联合溶瘤病毒T-VEC,在恶性黑色素瘤中,有效率超70%,完全缓解率突破30%,非常有作用。
联合个性化肿瘤疫苗:基于肿瘤基因突变所产生的新生抗原(neoantigen),可以设计和合成多肽或RNA疫苗。PD-1抗体联合这类私人订制、个性化肿瘤疫苗,已经有初步的成功经验,可以预防肿瘤复发,可以初步临床治愈晚期肿瘤。
联合特异性肿瘤免疫细胞治疗:PD-1抑制剂联合CAR-T等新型的特异性肿瘤免疫细胞治疗,在血液肿瘤中,已有初步的、不俗的数据。
三、如何预测PD-1的效果?
PD-1抑制剂在未经选择的实体瘤患者中,有效率仅有10%-30%;究竟哪些患者能够最终获益,医学科研人员仍在不断研究,目前主要的评价指标有以下4种,仅供临床医生参考:
① PD-L1表达
PD-1与PD-L1如同一对“情侣”,其中PD-1位于免疫细胞的表面,而PD-L1则位于肿瘤细胞的表面。这对“情侣”一旦结合,负责杀伤肿瘤细胞的免疫细胞就会把肿瘤细胞当作“朋友”,从而不再对其进行攻击。
研究发现:当肿瘤细胞表面有PD-L1的表达,那么使用PD-1抑制剂或者PD-L1抑制剂抑制肿瘤的概率就会增加,所以,肿瘤组织中PD-L1的表达情况,就成为预测PD-1/PD-L1抑制剂有效率的一个指标。在非小细胞肺癌的临床实验中,人们发现,如果肿瘤组织中PD-L1的表达率超过50%,PD-1抑制剂可以作为首选治疗方法治疗肿瘤,而如果PD-L1的表达率>1%,免疫检查点抑制剂可以使一线化疗失败的肺癌患者获益。
② MSI(微卫星)检测
微卫星不稳定性是我们身体中基因的一种病态情况,与肿瘤的发生密切相关。
研究表明:如果肿瘤组织中微卫星处于高度不稳定的状态,即MSI-H,使用PD-1抑制剂的有效率高于微卫星不稳定性低的状态(MSI-L)和微卫星稳定的状态(MSS)。所以,MSI-H就成为了预测PD-1抑制剂的一个重要的生物标志物。
③ 肿瘤基因突变负荷(TMB)检测
肿瘤突变负荷高,从免疫治疗中获益的概率就大。
在CheckMate-032临床研究中,按照TMB高低划分成TMB高、TMB中、TMB低三类病人,在接受联合治疗的人群中,三组的有效率分别为62%、20%、23%;而三组的中位总生存期,分别为:22.0个月、3.6个月、3.4个月;22.0个月与3.4个月,相差6倍!所以,TMB也是预测PD-1抑制剂的一个重要的生物标志物指标。
④ 肿瘤浸润淋巴细胞(TIL)检测
通过免疫组化染色(CD3、CD4、CD8等),可以看出肿瘤组织中是否有较多的淋巴细胞浸润。浸润的淋巴细胞越多,PD-1抑制剂的有效率越高。
四、如果PD-1起效,到底应该用多久?
目前国内外标准的方案是:
① 手术或同步放化疗后,巩固性、辅助性使用的患者,PD-1抑制剂建议用满1年;
② 晚期的、全身转移的病友,建议用满2年。
然而,越来越多的证据支持,使用PD-1抑制剂满6个月,且肿瘤缩小达到完全缓解、部分缓解(肿瘤缩小超过30%以上)的患者,可以再巩固2-3次后,酌情停药或调整剂量和间隔。
五、PD-1耐药后应该怎么办?
PD-1抑制剂有效的病人,一般疗效持久;但是,目前已经观察到30%左右的患者,出现了疾病的耐药。克服耐药的关键,主要是两点:
首选,如果可能,可以通过对新增的或者不断增大的耐药部位,进行穿刺活检和深入的免疫分析,找到耐药的原因,根据原因治疗。比如,有的患者是由于TIM-3、LAG-3或IDO代偿性高表达;那么选择,PD-1抑制剂联合TIM-3抑制剂、LAG-3抗体、IDO抑制剂,就是最好的治疗方案。
其次,对于不能明确耐药原因的患者,可以结合具体病情,选择最佳的联合搭档,逆转耐药,延长生存期;或者,更换为放化疗、介入、射频、粒子植入等传统治疗。
六、使用PD-1,患者需要注意哪些问题?
首先,以下患者不适合、不建议尝试PD-1抑制剂:
病情进入终末期、卧床不起的病人;
有急性细菌感染,尚未控制的病人;
做过肝移植、肾移植的病人;
有系统性红斑狼疮、白塞病、干燥综合征、血管炎等自身免疫病,尚未控制的病人;
携带MDM2扩增、EGFR突变、JAK突变等病人等(有些患者可以首选靶向治疗)。
其次,使用PD-1抑制剂前,一般建议完善以下检查,基本正常后再使用:血常规、肝肾功、电解质、凝血、甲状腺功能,心电图、腹部B超、胸部X线。
最后,也是最重要的一点:越来越多的证据支持,PD-1抑制剂应该在患者一般情况比较好,肿瘤负荷比较小的时候,尽早用。