2018年值得关注的肿瘤免疫疗法、基因疗法和RNA疗法
1、 肿瘤免疫疗法方兴未艾
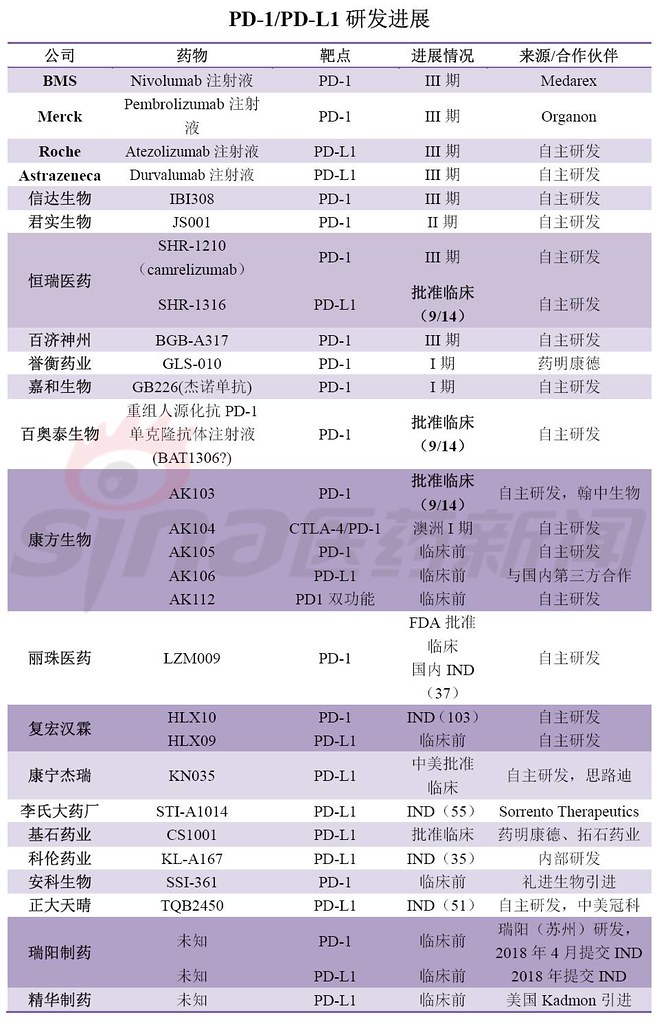
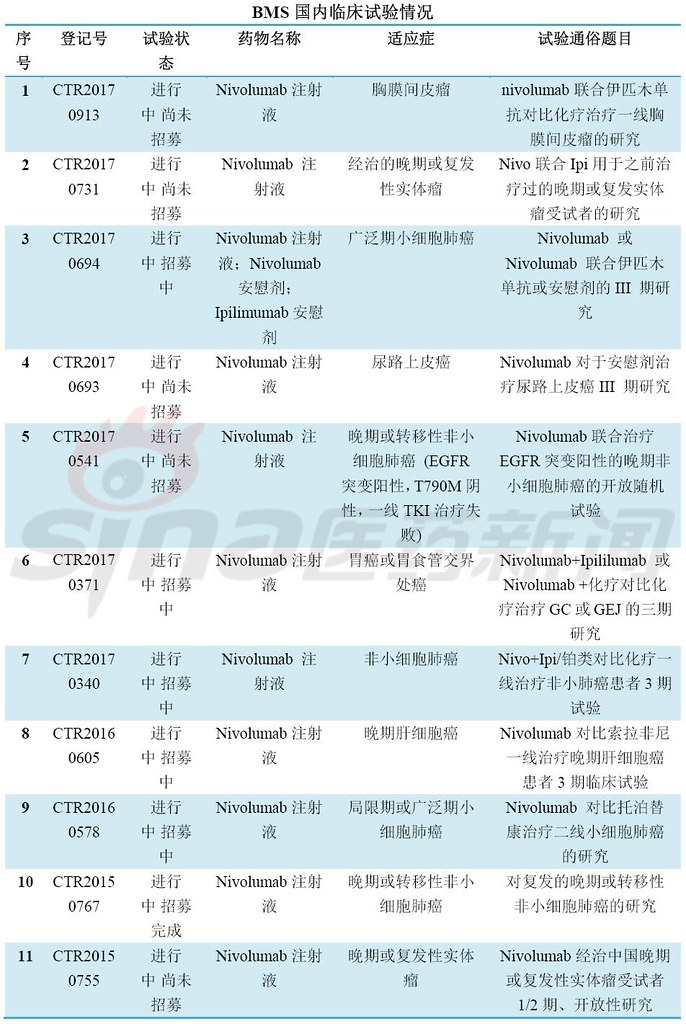
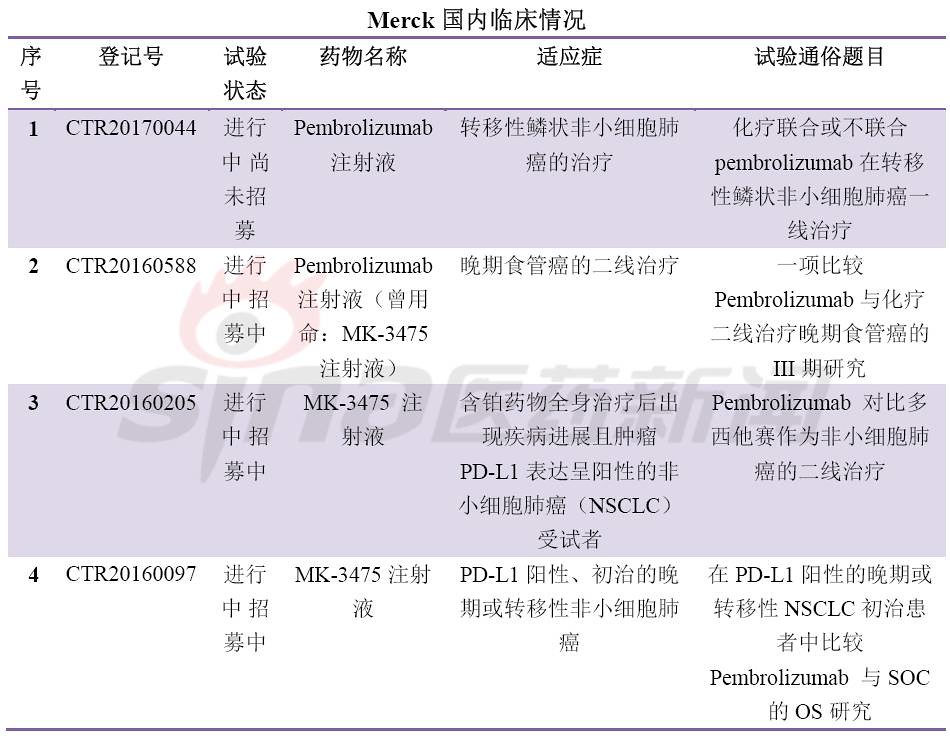
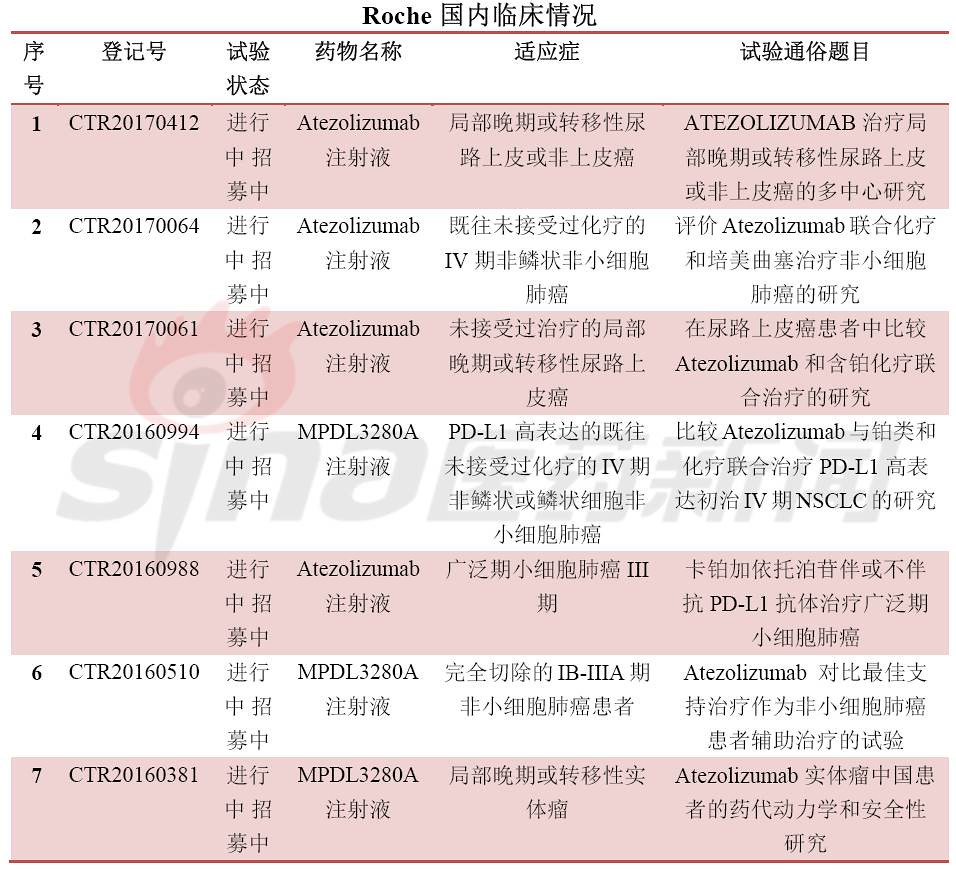
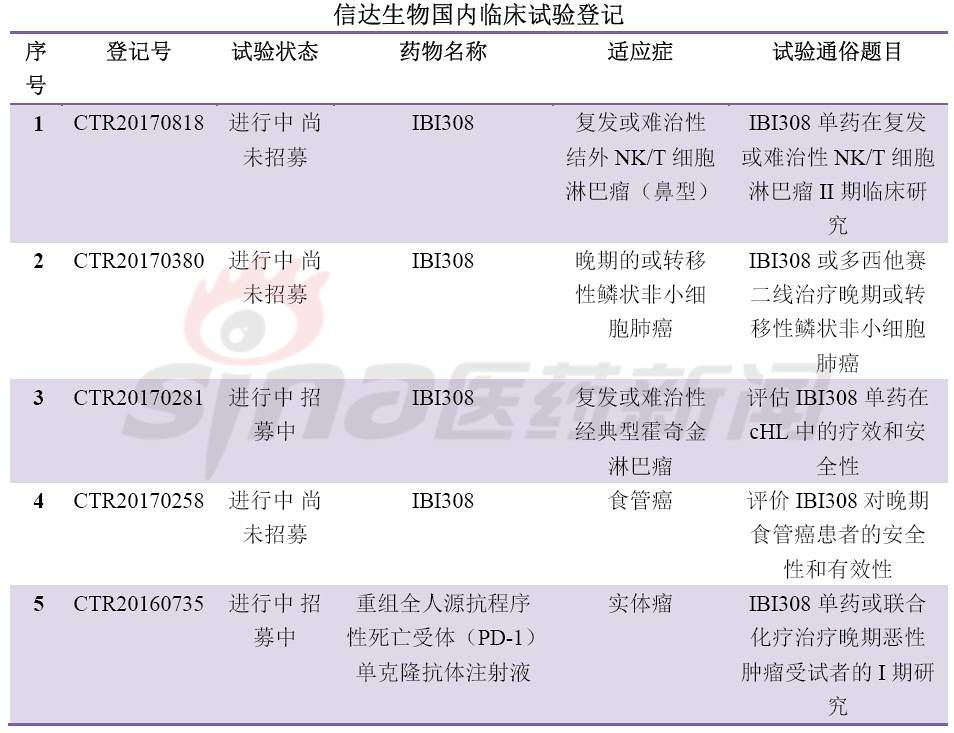
肿瘤免疫疗法(IO)是当前药物研发的焦点,其中最热门的靶点当属PD-1/PD-L1。全球共有5个PD-1/PD-L1新药上市,分别是Opidivo(BMS),Keytruda(MSD),Tecentriq(Roche),Imfinizi(Astrazeneca),Bavencio(Merck KGaA/Pfizer)。12月初,信达递交了首个国产PD-1单抗上市申请,也拉开了国内PD-1/PD-L1新药上市的序幕。
目前全球开展了大量的研究,新的检查点(checkpoint)靶点的临床试验和项目值得密切关注。最值得期待是IDO靶点,这是一种抑制免疫系统的关键酶,能够促进调节T细胞的生成,并抑制效应T细胞的激活。因此,IDO酶能帮助肿瘤细胞逃脱免疫系统的监视,让它们继续生长。
Incyte在IDO抑制剂开发方面处于领先地位。2018年上半年,Incyte将发布该领域第一个严格的3期临床数据。这项名为Echo-301的试验评估了epacadostat与Keytruda组合一线治疗黑色素瘤的效果。黑色素瘤的临床治疗曾被PD-1单抗的横空出世而改变。IDO抑制剂与PD-(L)1和组合产生的不仅仅是增量效益,而且有望在PD-(L)1和CTLA4靶点之后,增加一种全新的检查点抑制剂类别。这个大型的临床研究一旦能够在黑色素瘤上证实有效,将会给其他瘤种带来希望。
另一个重要的IO靶点是Lag3,BMS的relatlimab抗体已经在抗PD-(L)1单抗治疗后疾病仍然进展的Lag3阳性患者身上证实有效。此外,Nektar公司的CD122激动剂NKTR-214与Opdivo组合疗法,可以使PD-L1表达阴性的患者有反应,有望将他们的“冷”肿瘤转变为“热”肿瘤。
除了以上提到的检查点靶点,2018年还有大量针对其他新靶点的免疫组合疗法开展研究,其中值得关注的靶点包括Tim3,CD40,Icos,ITR,CEA,TLR9,4-1BB(CD137)。新的数据会给投资者一个更明确的答案——检查点抑制剂组合策略与PD-(L)1抑制剂相比,能否产生更好的疗效。
需要注意的是,目前人们对IO领域的期望太高,Ox40,CSF-1R和Kir这些靶点出现的挫折提醒我们需要冷静管理期望值。新药研发中的失败可能是我们必须接受的常态。阿斯利康(AstraZeneca)首席执行官Pascal Soriot先生曾在去年十月份的新闻发布会上说过:“人们总是高估近期的变化,低估新技术的长期影响力。这种情况也可能发生在肿瘤免疫学上。”
明年,有几个非常重要的一线治疗肺癌的试验结果会公布,这些研究也将奠定免疫肿瘤学在2018年的基调。上半年,BMS的Checkmate-227试验将迎来结果,Astrazeneca公司Mystic试验在无进展生存期(PFS)上未达到临床终点,接下来的整体生存率(OS)的结果令人期待。由于更换了试验设计,Merck公司的Keynote-189数据可能会推迟到2019年。最近罗氏公布的数据令人鼓舞。11月份,罗氏的Impower-150试验显着延长了无进展生存期(PFS),该试验评估了Tecentriq+ Avastin+化疗的三联疗法的疗效,对照药物包含目前的肺癌一线疗法Avastin+化疗。该研究的全部数据,包括共同主要终点总生存期(OS)按计划会在2018年上半年发布。研究人员透露OS的最初观察结果令人振奋。如果Tecentriq相比现有治疗方案的优势得到证实,将有望改变非小细胞肺癌的治疗标准。
2、非癌症领域值得关注的新药和里程碑事件
2018年除了新的癌症免疫疗法,其他治疗领域也有新药会迎来重要里程碑。
首先是小型生物制药公司表现亮眼。Spark Therapeutics治疗特定遗传性眼疾的创新基因疗法Luxturna(voretigene neparvovec-rzyl)去年12月20日获批上市,成为首款在美国获批、靶向特定基因突变的“直接给药型”基因疗法,而且比预期提前了一个多月上市。
另外一款基因疗法也引人注目。AveXis公司的AVXS-101是治疗脊髓性肌萎缩(SMA)1型的基因疗法,旨在通过治疗主要SMN基因的缺陷和/或丢失,来解决SMA的单基因问题并防止肌肉的进一步退化。去年11月份,AveXis公司公布的1期临床试验结果令人惊喜:进行AVXS-101治疗的所有15例患儿(年龄在20个月左右)全部存活且没有不良反应,这意味着他们一天中的大部分时间都不需要依靠呼吸机呼吸。而且没有重大安全问题出现。去年12月份,AveXis公司宣布启动AVXS-101在2型SMA患者中的1期临床试验。因为AVXS-101靶向SMA的根本病因,该公司乐观地认为有望在2型SMA患者的试验中观察到类似的疗效。
Alnylam和Ionis公司的开创性RNA疗法也在审批流程当中。Alnylam在去年12月份已经向美国FDA提交了历史上首个RNAi疗法patisiran的新药申请(NDA)并且申请进行优先审评,如果获得批准,审评期可能缩短至六个月。Patisiran是一种靶向甲状腺素运载蛋白(TTR)的在研RNAi疗法,用于治疗患有遗传性甲状腺素运载蛋白淀粉样变(hATTR淀粉样变)的成年患者。
Ionis 公司治疗亨廷顿病的在研新药IONIS-HTTRx是一款靶向编码HTT蛋白的mRNA的反义(antisense)创新疗法,在临床1/2a期试验中,它显着降低了患者体内的突变亨廷顿蛋白的产生。罗氏准备以4500万美元的价格,接手对IONIS-HTTRx的全部后续临床开发。罗氏最近启动了开放标签扩展试验继续评估IONIS-HTTRx的长期疗效。IONIS-HTTRx已经获得了美国FDA和欧洲药品管理局授予的孤儿药资格。
另外,几款治疗偏头痛的抗CGRP疗法有望问世,包括Aimovig(Amgen/Novartis),galcanezumab(Eli Lilly),Fremanezumab(Teva)。12月,galcanezumab和fremanezumab先后递交了生物制剂许可申请(BLA);Fremanezumab同时还被授予优先审评和快速通道资格。
3、2018有望上市的TOP12重磅新药
Evaluate根据2022年的销售额预测,提出了2018年有望上市的12大重磅新药。其中诺和诺德(Novo Nodisk)的糖尿病新药Semaglutide已经早于预期获得FDA批准上市(2017年12月15日)。其他即将上市的新药中,Gilead治疗艾滋病的Bictegravir和FTC/TAF的组合疗法的PDUFA日期(目标批准日期)是2月12日。新的HIV三联疗法获批,将进一步巩固Gilead在HIV感染和艾滋病治疗领域的领军地位。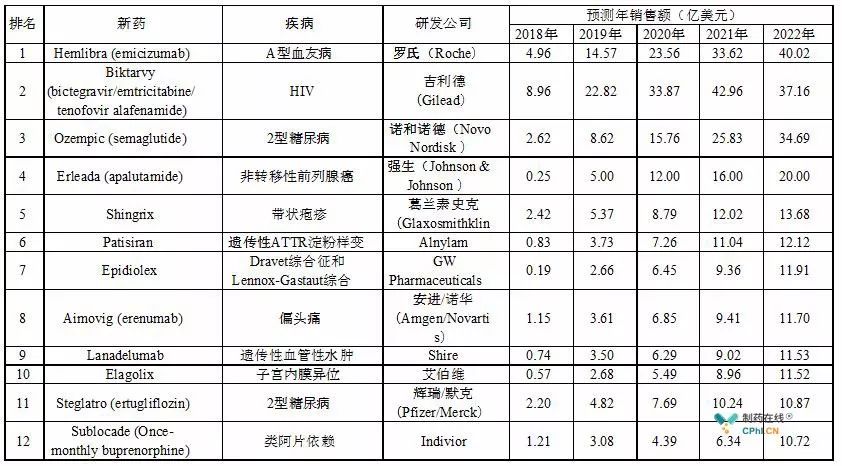
在癌症领域,靶向IDO1酶的同类首个(first-in-class)高效选择性口服抑制剂Epacadostat前面已经提到,这是今年最受关注的肿瘤免疫疗法之一。艾伯维(AbbVie)的Rova-T是一种在研的抗体药物偶联物,能够靶向DLL3蛋白,同时能够靶向癌症干细胞,该药正在与BMS的Opdivo和Yervoy开展组合疗法的临床试验,治疗复发性广泛期小细胞肺癌(SCLC),2期临床结果将在2季度公布。强生(Johnson & Johnson)的apalutamide是一款用于治疗未转移的去势抵抗性前列腺癌的雄激素受体抑制剂,12月21日,强生向FDA递交了新药申请(NDA)并且获得优先审评资格,意味着将在六个月内完成审批。
在其他疾病领域,Celgene公司的ozanimod是一种治疗多发性硬化症的全新口服药物。去年11月,Celgene公布了一项3期临床试验的详细结果,该试验证实了与β-1a干扰素(IFN)相比,ozanimod能够显着降低多发性硬化症复发。根据这项试验的出色结果,Celgene计划在今年底向美国FDA递交上市申请。
AbbVie公司出现在该榜单的第2种药物elagolix是一种口服型促性腺激素释放激素(GnRH)受体拮抗剂短效分子,治疗子宫内膜异位症和相关疼痛。去年10月底,elagolix获得美国FDA颁发的优先审评资格。AbbVie预计PDUFA日期在2018年第二季度。
在罕见病方面,Shire公司的lanadelumab(SHP643)是一种抑制激肽释放酶(Kallikrein)功能的单克隆抗体,用于治疗遗传性血管性水肿(HAE)。去年5月,Shire公布了临床3期试验的结果,平均HAE发作频率显着降低87%,该药物已经获得了FDA和欧盟药物管理局(EMA)颁发的孤儿药资格和突破性疗法认定。Shire计划在2018年初向美国FDA提交新药申请(BLA)。
该榜单的最后一个药物是GW制药公司的Epidiolex,这是一种纯植物来源的大麻二酚(cannabidiol,CBD)口服制剂,就在去年12月28日,GW刚刚向FDA递交了新药申请(NDA)并获得优先审评资格,Epidiolex用于治疗耐药性Lennox-Gastaut综合征(LGS)和Dravet综合征——两种罕见和难治性的儿童期发作的癫痫,PDUFA目标日期是2018年6月27日。
对医药行业来说,2017年是不平凡的一年。我们期待行业能在2018年保持这个良好的势头,为全球患者带来更多重磅新疗法!
参考文献:Drugs to Watch 2018:12 new drugs are forecast to enter the market in 2018 and achieve blockbuster sales of $1 billion or more by 2022