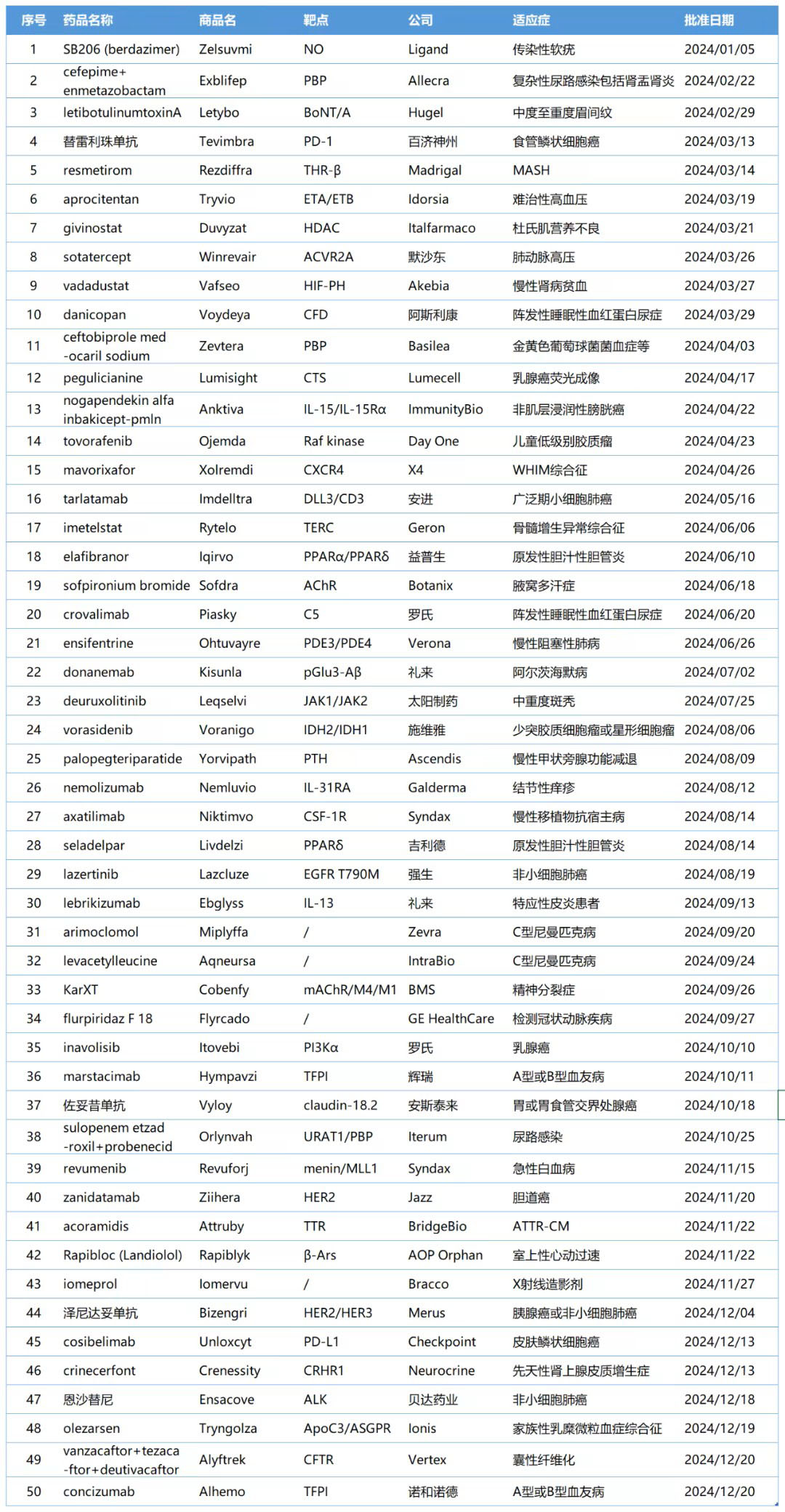
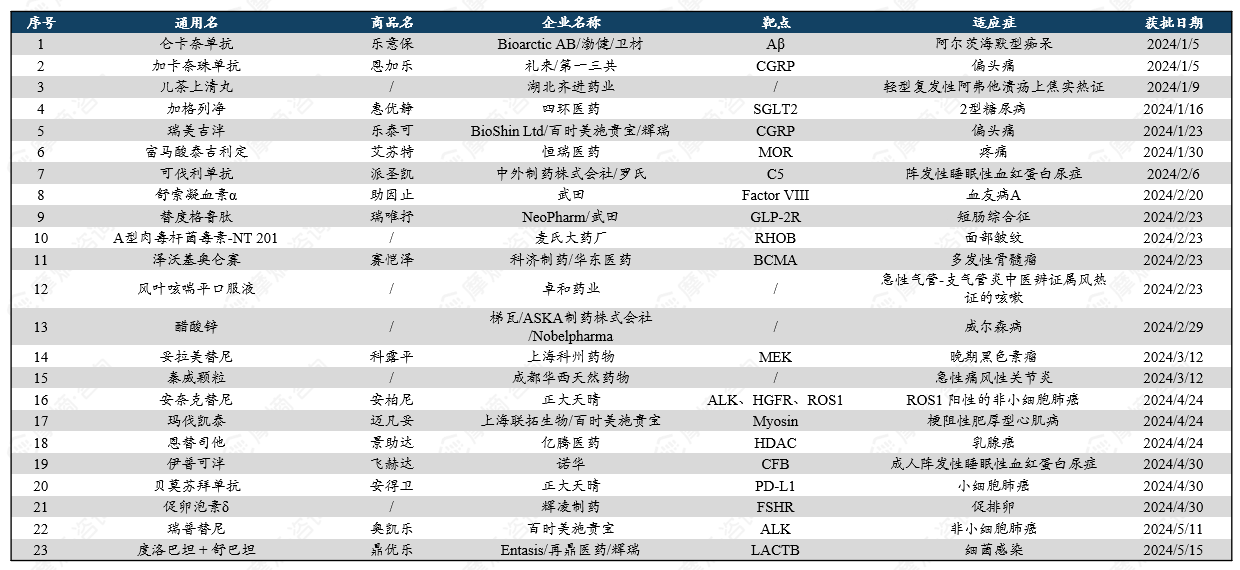
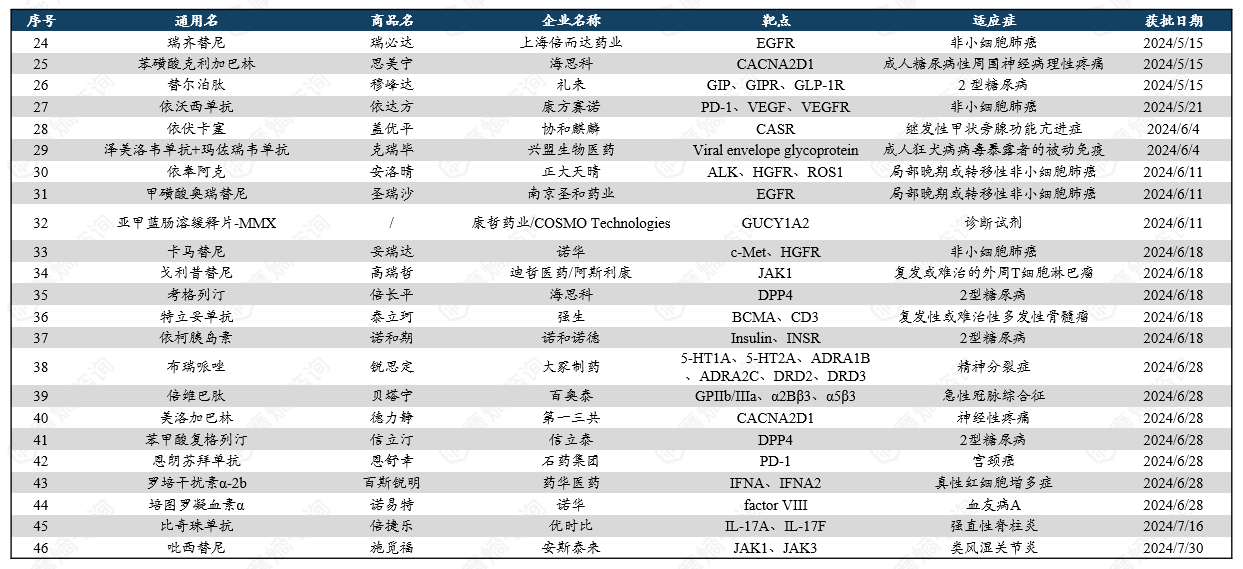
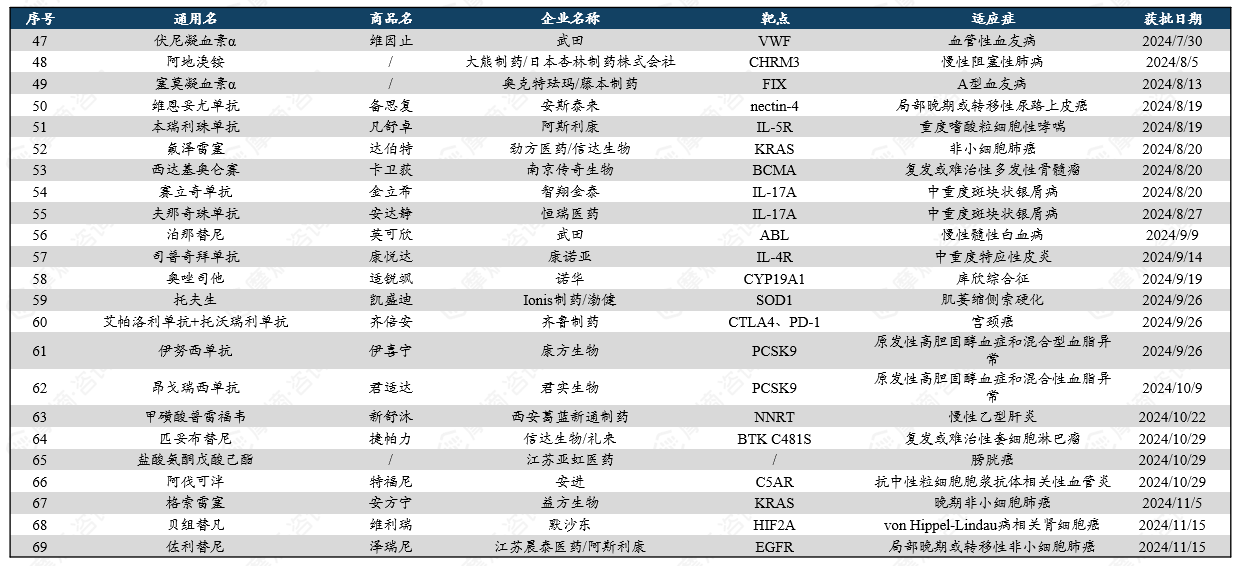
2024年美国FDA药品评价与研究中心(CDER)共批准了50款新药,其中包括34款新分子实体和16款生物大分子药物。新分子实体中,小分子居多,占比约达91%(31款),其余包括核酸与多肽类药物;生物制品中,81%为抗体类(10款单抗、3款双抗),其余为融合蛋白及A型肉毒毒素。相比2023年同期获批数量(53款),今年FDA批准新药数量有所下降。
统计在获批的新药中,化学小分子药物依旧是创新主力,以64%的占比遥遥领先,这些新药涵盖靶点LACTB、PBP、THR-β、Raf、PDE3/4、HIF等;其次是单克隆抗体,有13款(占比26%);蛋白类药物2款(占比4%);小核酸药物2款(占比4%);甲状旁腺激素类似物1款(占比2%)。
获批新药治疗的疾病多样,其中,治疗罕见疾病和癌症的新药总数名列前茅。在抗感染和中枢神经系统疾病领域也有多款新药获批。
首次获批药物亮点
· 精神分裂症治疗药物—Cobenfy
今年最受期待的批准之一是Karuna和Bristol Myers Squibb的固定剂量组合药物Cobenfy(xanomeline和trospium),用于治疗精神分裂症。这是近几十年来首次获批的具有全新机制的治疗该精神疾病的药物。虽然该药仍存在较为明显的胃肠道副作用及肝脏损伤风险,但BMS在2024年斥资140亿美元收购了Karuna和KarXTin,足见该药的发展潜力巨大。分析师预测这种联合疗法的年销售额有望超过30亿美元。
· 首款非酒精性脂肪性肝(NASH)治疗药物—Resmetirom(Rezdiffra)
非酒精性脂肪性肝(NASH)药物的首次批准也在2024年姗姗来迟。Madrigal公司的Resmetirom(Rezdiffra)获批,这是一种口服甲状腺激素受体β(THR-β)激动剂,用于治疗伴有肝纤维化的非酒精性脂肪性肝炎(NASH,现称:代谢功能障碍相关性脂肪性肝炎(MASH))。Resmetirom能够调节脂代谢,降低LDL-C、甘油三酯和致动脉粥样硬化性脂蛋白,还可以通过促进脂肪酸的分解和刺激线粒体的生物发生来减少脂肪毒性并改善肝功能,进而减少肝脏脂肪。目前该药的治疗效果只达到中等水平,但却是第一种有望成功的药物。分析师预测,其最高销售额将超过33亿美元。
· 实体瘤的首款T细胞疗法—Amtagvi(lifileucel)
2024年2月16日,美国FDA加速批准了Iovance Biotherapeutics的肿瘤浸润淋巴细胞(TIL)疗法Amtagvi(lifileucel),用于治疗晚期黑色素瘤。Amtagvi是首款获批的TIL疗法,也是首款获批治疗实体瘤的T细胞疗法,堪称细胞疗法的又一里程碑。尽管该药可能带来明显副作用并且价格昂贵,但分析师预测其最高销售额将超过11亿美元。
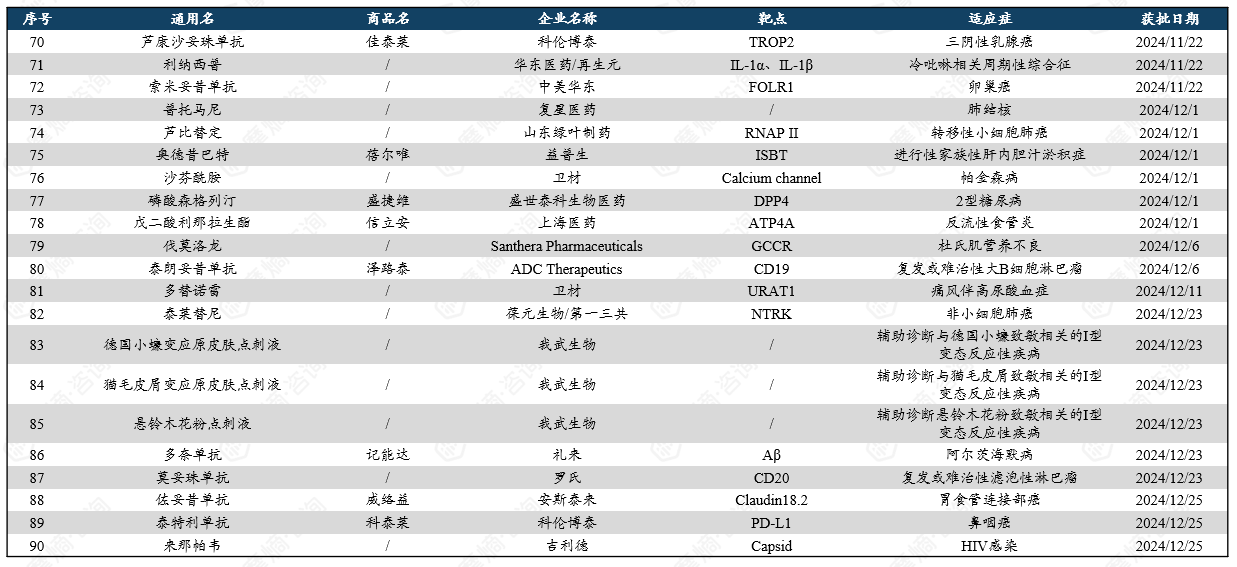
2024年FDA获批新药: